L'entropia
Se il primo principio della termodinamica si può formulare in maniera generale dicendo che l’energia totale dell’Universo è costante, per il secondo principio questa energia non può trasformarsi liberamente da una forma a un’altra, ma esistono delle limitazioni. Per esempio, l'energia termica non può passare da un corpo più freddo a uno più caldo, o meglio è estremamente improbabile che questo accada. Inoltre, sempre per il secondo principio della termodinamica, la produzione di lavoro è sempre accompagnata da un riscaldamento. Questo significa che esiste nell'Universo una tendenza spontanea al passaggio verso una forma di energia (il calore) che non è completamente ritrasformabile in un'altra forma di energia, cioè una tendenza verso una forma "degradata" di energia, che non è più utilizzabile.
In accordo con il secondo principio della termodinamica, si può dire quindi che esiste nei sistemi fisici una tendenza alla degradazione dell'energia e quindi alla sua dispersione nell'ambiente. Questo concetto è strettamente legato al fatto che ogni trasformazione fisica spontanea avviene in un verso determinato: per esempio, il calore passa da un corpo più caldo a uno più freddo, ma non viceversa; l'acqua presente su una superficie libera tende a evaporare, ma il vapore acqueo prodotto non tende spontaneamente a ritrasformarsi in liquido; una palla lasciata rimbalzare al suolo tende a cadere verso il basso, fino a fermarsi a causa dell'attrito. Il processo inverso di questi tre esempi è in accordo con il primo principio della termodinamica, perché l'energia di un sistema in cui il calore passa da un corpo più freddo a uno più caldo, per esempio, si conserva, ma non lo è con il secondo.
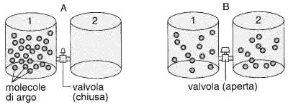
Si consideri un sistema fisico costituito da un recipiente contenente un gas, libero di espandersi in un altro contenitore vuoto, collegato al primo tramite una valvola (v. fig. 14.4): inizialmente tutte le molecole del gas si trovano nel primo contenitore, ma se la valvola viene aperta il gas tende spontaneamente a passare nel secondo contenitore, e le sue molecole si distribuiscono uniformemente all'interno dell'intero volume disponibile, rappresentato dai due contenitori. Nulla vieta che le molecole del gas restino nel primo contenitore, o, analogamente, si trasferiscano interamente nel secondo, svuotando il primo, ma questo non accade. Una volta che il processo è avvenuto, ovvero una volta che tutte le molecole si sono uniformemente distribuite all'interno dei due contenitori, è altamente improbabile che il sistema ritorni spontaneamente allo stato di partenza, ovvero che tutte le molecole del gas ritornino spontaneamente nel primo contenitore. Il processo dunque è irreversibile.
Il sistema tende spontaneamente a passare da un iniziale stato più ordinato (tutte le molecole nel primo contenitore) a uno finale più disordinato (le molecole distribuite uniformemente nei due contenitori). Un esempio analogo è quello del passaggio del calore da un corpo più caldo a uno più freddo, che, una volta avvenuto, non tende spontaneamente a verificarsi in senso contrario: anche in questo caso il sistema è passato da uno stato iniziale di ordine (un corpo caldo e uno freddo) a uno stato finale di disordine (i due corpi a uguale temperatura) e il processo non avviene spontaneamente in senso inverso, ovvero è irreversibile.
Generalizzando, si può dire che un sistema fisico isolato soggetto a trasformazioni spontanee tende verso il suo stato di massimo disordine.
Per chiarire questo concetto viene introdotta in fisica una grandezza, detta entropia e indicata solitamente con S, che esprime il grado di disordine di un sistema fisico. In termini di entropia, il secondo principio della termodinamica si formula dicendo che ogni trasformazione spontanea di un sistema fisico isolato è irreversibile e porta a un aumento dell'entropia. L'entropia è una funzione di stato, ovvero dipende solo dallo stato iniziale e finale del sistema, ed è indipendente dal tipo di trasformazioni subite dal sistema nel passare da uno stato all'altro. In un sistema termodinamico che subisce una trasformazione, la variazione di entropia di un processo reversibile si definisce come il rapporto tra la quantità di calore scambiato dal sistema e la temperatura assoluta a cui avviene lo scambio, ovvero:
L'unità di misura dell'entropia nel Sistema Internazionale è il J/K, joule su grado kelvin. L'entropia dunque è una grandezza misurabile e rappresenta un indice dello stato di disordine del sistema fisico. Il secondo principio della termodinamica assume quindi la forma:
dove il segno di uguaglianza vale per i processi reversibili, mentre quello di disguaglianza per i processi irreversibili.
Se si considera l'intero Universo come un sistema isolato termicamente, nel quale tutti gli scambi di calore con un eventuale ambiente esterno sono nulli e nel quale le trasformazioni spontanee sono irreversibili, il secondo principio della termodinamica si può scrivere:
che stabilisce che l'entropia dell'Universo è in continuo aumento. Questo, per quanto detto precedentemente, implica anche che l'energia totale dell'Universo, pur mantenendosi costante in accordo con il primo principio della termodinamica, vada verso un grado di massima degradazione, ovvero che l'energia utile dell'Universo (quella che può essere trasformata spontaneamente in lavoro) è in continua diminuzione, mentre cresce la frazione di energia termica, o calore, a causa degli attriti.