Le leggi dei gas
Il comportamento di un gas perfetto è completamente definito da tre variabili indipendenti, dette variabili di stato, che sono la pressione (simbolo p) che il gas esercita sul recipiente, il volume (simbolo V) occupato dal gas e la temperatura (simbolo T, misurata in kelvin). Le relazioni tra le variabili di stato, dette leggi dei gas, definiscono completamente il comportamento di un gas in tutte le situazioni fisiche. Mantenendo costante una delle tre grandezze, e variando le altre due, si ottengono le tre leggi empiriche dei gas perfetti, ricavate sperimentalmente prima del XVIII secolo.
Una trasformazione che avviene in un gas mantenendo costante la sua temperatura, e facendo variare pressione e volume, si dice trasformazione isoterma; una trasformazione a pressione costante si dice isobara, mentre una trasformazione a volume costante si dice isocora.
La legge di Boyle (v. fig. 13.1 A), enunciata nel 1662 dal chimico irlandese R. Boyle (1627-1691), stabilisce che a temperatura costante il volume di un gas è inversamente proporzionale alla sua pressione, ovvero che:
La legge di Charles (v. fig. 13.1 B), formulata nel 1787 dal fisico francese J. Charles (1746-1823), dice che a pressione costante il volume di un gas è direttamente proporzionale alla sua temperatura assoluta:
La legge di Charles fu ricavata come legge di dilatazione dei gas allorché Charles scoprì che tutti i gas, a pressione costante, subiscono la stessa dilatazione all'aumentare della temperatura, secondo una legge data dalla relazione:
dove la temperatura è misurata in gradi centigradi, V è il coefficiente di dilatazione termica del gas. Secondo questa formulazione deve esistere una temperatura limite (inferiore a 0 °C) tale per cui il gas non occupa alcun volume. Tale temperatura si può ricavare uguagliando a zero il termine tra parentesi del secondo membro della legge di Charles, e si ottiene:
pari al valore T = 0 K nella scala kelvin, detta anche delle temperature assolute.
La legge di Gay-Lussac (v. fig. 13.1 C), formulata nel 1801 dal chimico e fisico francese J. Gay-Lussac (1778-1850), stabilisce che a volume costante la pressione di un gas è direttamente proporzionale alla sua temperatura assoluta:
Analogamente al caso precedente, la legge di Gay-Lussac fu formulata come legge che esprimeva la dipendenza della pressione dalla temperatura in un gas mantenuto a volume costante, nella forma:
dove è lo stesso coefficiente di dilatazione termica della legge di Charles. La temperatura dello zero assoluto è tale per cui il gas non esercita più alcuna pressione.
Le tre leggi dei gas descritte sopra sono riassunte dall'equazione di stato dei gas perfetti, che stabilisce che la pressione di un gas, moltiplicata per il suo volume, è direttamente proporzionale alla sua temperatura assoluta e al numero di moli, n, del gas secondo la relazione:
dove R = 8,31 J/Kmol è detta costante dei gas.
Se N è il numero di molecole del gas, e n= N/N
dove k = R/N
L'equazione di stato dei gas reali
In condizioni di temperatura e pressione vicine a quelle ambientali la maggior parte dei gas segue con buona approssimazione l'equazione di stato dei gas perfetti. Alle alte pressioni e alle basse temperature si manifestano invece deviazioni più o meno marcate da tale legge, in quanto il volume proprio posseduto dalle molecole e le forze di attrazione reciproche tra le molecole e tra le molecole e il recipiente non si possono più considerare trascurabili. Ne consegue che il volume libero entro cui si muovono le molecole del gas risulta inferiore a quello teorico, mentre le forze di coesione creano una pressione interna e una diminuzione della pressione del gas sulle pareti del recipiente. Per tener conto di questi fattori, sono state introdotte varie equazioni di stato, modificate per i gas reali; tra queste si segnala quella proposta attorno al 1881 dal fisico olandese J.D. van der Waals (1837-1923), detta equazione di van der Waals per i gas reali, che si esprime nella forma:
dove a e b sono due costanti, caratteristiche di ogni gas, ricavate sperimentalmente.
Media correlati
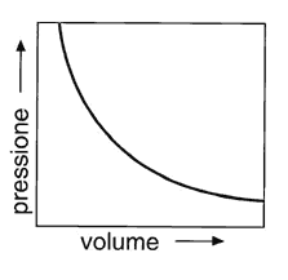
Figura 13.1a Rappresentazione grafica indicativa delle leggi dei gas perfetti: (A) legge isoterma di Boyle; (B) legge isobara di Charles; (C) legge isocora di Gay-Lussac.
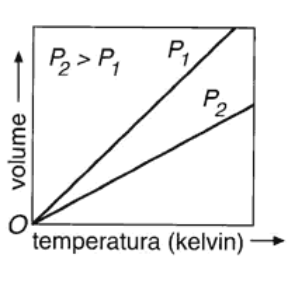
Figura 13.1b B
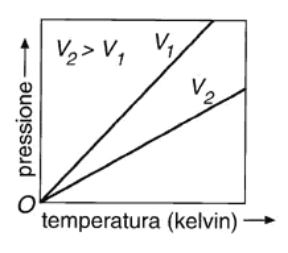
Figura 13.1c C


